Глиальный фибриллярный кислый белок (GFAP) является основным структурным белком астроцитов (астроглии) центральной нервной системы (головного и спинного мозга), также он обнаружен в немиелинизирующих клетках Шванна периферической нервной системы. Он поддерживает форму клетки и участвует в регуляции процессов, связанных с пролиферацией клеток, синаптической пластичностью, а также функцией гематоэнцефалического барьера.
Биохимия GFAP
GFAP принадлежит к группе белков промежуточного филамента III. На сегодняшний день описано десять изоформ GFAP. Однако клиническое значение имеет только преобладающая изоформа (изоформа 1 или GFAP-α) (1).
GFAP представляет собой фибриллярный белок приблизительно 50 кДа. Формирование филаментов включает латеральную димеризацию GFAP и полимеризацию образующихся димеров "голова к хвосту". Белок является высококонсервативным у разных видов и очень похож на некоторые другие белки, которые также участвуют в образовании промежуточных филаментов, например, виментина, десмина, периферина и альфа-интернексина.
GFAP как маркер в диагностике
GFAP является маркером повреждения глиальных клеток. В условиях, когда глиальные клетки повреждены, GFAP высвобождается из клеток и затем появляется в крови. GFAP может быть обнаружен в образцах крови вскоре после повреждения (2,3).
Маркер черепно-мозговой травмы (ЧМТ). Новые данные показали, что GFAP может использоваться в качестве биомаркера ЧМТ. Было показано, что в случае легкой и умеренной ЧМТ уровни GFAP демонстрируют заметное повышение через восемь часов после травмы (3). В дополнение, чтобы предсказать исход травмы, было предложено измерять концентрацию GFAP. (4). Более того, Управлением по контролю за продуктами и лекарствами был одобрен один тест для оценки легкой ЧМТ, который измеряет GFAP (и UCH-L1) (5).
Разграничение между геморрагическим и ишемическим инсультом. Все большее число исследований показали, что GFAP может быть полезным биомаркером для дифференциации между геморрагическим и ишемическим инсультом. Оба могут иметь серьезные последствия, но, поскольку эти две формы инсультов имеют разные механизмы, они требуют противоположных стратегий лечения. Поэтому важно как можно раньше найти инструменты, которые помогают различать две формы инсультов. Исследования показали, что концентрация GFAP увеличивается в случае геморрагического инсульта в течение двух часов после начала инсульта, причем пик наступает между 6 и 12 часами после начала инсульта. В свою очередь, в случае ишемического инсульта, уровни GFAP в крови повышаются в более поздний момент времени (2,6).
Реагенты для определения GFAP
Компания Хайтест предлагает несколько моноклональных антител (МоАт), специфичных к GFAP. Также мы предлагаем рекомбинантный антиген GFAP, который можно использовать в качестве стандарта или калибратора в иммуноанализах.
|
Клиническое использование
- Черепно-мозговая травма (ЧМТ)
|
Хайтест предлагает несколько хорошо охарактеризованных
моноклональных антител (МоАт), которые специфичны
к GFAP и которые могут быть использованы для
количественного определения GFAP в сыворотке, плазме
или спинномозговой жидкости.
Сэндвич-иммуноанализы для выявления GFAP
Для обнаружения GFAP в образцах цитратной или
гепариновой плазмы, а также в образцах сыворотки с
помощью сэндвич-иммуноанализа, мы рекомендуем
три пары МоАт (см. Таблицу 1). Они не показали кросс-
реактивности с виментином, десмином, периферином
или альфа-интернексином. Калибровочная кривая с
использованием прототипа GFAP83cc-GFAP81cc анализа
показана на рисунке 1.
Таблица 1. Рекомендуемые пары (подложка-
детекция) для определения GFAP. Данные основаны на
результатах, которые были получены с использованием
сэндвич-хемилюминесцентного иммуноанализа (CLIA).
Аббревиатура LoD в таблице означает предел детекции.
| Антитело подложки |
Детекторное антитело |
LoD (пг/мл) |
| GFAP83cc |
GFAP81cc |
4.8 |
| GFAP94cc |
GFAP98cc |
15.3 |
| GFAP15cc |
GFAP81cc |
13.3 |
| GF5 |
GFAP98cc |
7.4 |
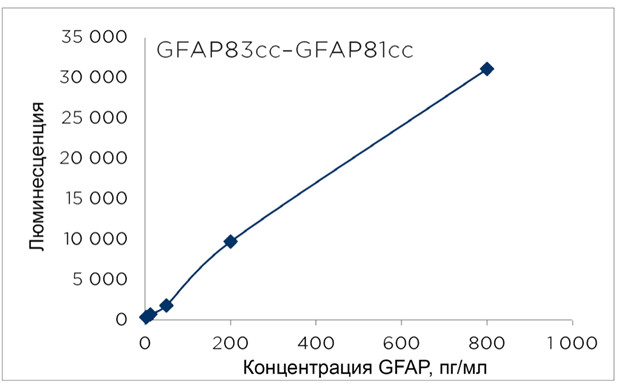
Рисунок 1. Калибровочная кривая для пары GFAP83cc-
GFAP81cc (подложка-детекция) с использованием
нативного GFAP в качестве антигена
Определение GFAP в клинических образцах
В рамках исследования мы измерили уровень детекции
GFAP в образцах плазмы пациентов с геморрагическим (N
= 5) или ишемическим (N = 5) инсультом с использованием
пары моноклонов GFAP83cc-GFAP81cc. Все образцы
были взяты в течение первых 12 часов после инсульта.
Результаты исследования представлены на Рисунке 2.
Анализ с использованием указанной пары обнаружил
GFAP в образцах плазмы только у пациентов, перенесших
геморрагический инсульт. Это соотносится с выводами
других исследований и позволяет предположить, что GFAP
подходит для исключения других типов инсульта. В случае
же ишемического инсульта уровень GFAP повыситься
позднее 12 часов.
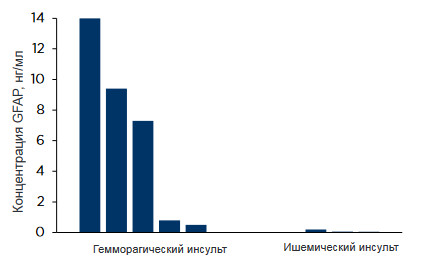
Рисунок 2. Измерение уровня GFAP в образцах
плазмы пациентов с геморрагическим и ишемическим
инсультом с помощью прототипа иммунометрического
анализа c парой моноклонов GFAP83cc-GFAP81cc.
Применение МоАт в иммуногистохимии
МоАт GFAP15cc, GFAP81cc, GFAP83cc и GF5 подходят
для использования в иммуногистохимии. Для примера мы
покрасили GFAP в глиальных клетках с использованием
моноклона GFAP81cc (Рисунок 3).
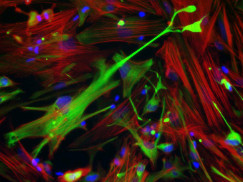
Рисунок 3. Окрашивание GFAP в культивируемых
глиальных клетках. Первичное антитело: GFAP81cc.
Вторичное антитело: кроличьи антимышиные поликлональные антитела, конъюгированные с Alexa-488
(зеленый).
Рекомбинантный GFAP
Наша компания предлагает рекомбинантный GFAP, который
подходит для использования в качестве калибратора
в иммуноанализах. Антиген состоит из аминокислот
60–383 человеческого GFAP и экспрессируется в E. coli.
Чистота антигена более 90%. SDS-PAGE рекомбинантного
GFAP показывает, что он мигрирует в виде одной
полосы с кажущейся молекулярной массой 34 кДа (см.
Рисунок 4). Обращаем ваше внимание, что GFAP – это
фибриллярный белок, склонный к полимеризации. Кроме
того, рекомбинантный GFAP склонен к образованию
димеров, поэтому очищенный белковый препарат с высокой
вероятностью будет содержать некоторое количество
димерного GFAP.
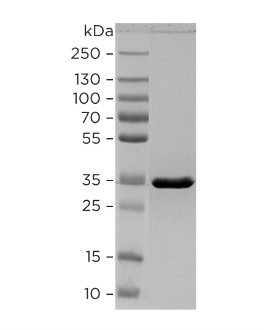
Рисунок 4. SDS-PAGE рекомбинантного фрагмента GFAP
в восстанавливающих условиях в градиентном геле (4-
20%). В гель погружали 2,5 мкг очищенного белка.
Как избежать преципитации рекомбинантного GFAP?
Полимеризация GFAP может привести к осаждению белка при
хранении. Особое значение в этом случае имеют температура,
концентрация и буфер. Мы рекомендуем хранить белковые
препараты при -70°C, восстанавливая лиофилизированный
продукт до исходной концентрации (всегда менее 1 мг/мл), и
избегать использования буферов с высокой ионной силой
(например PBS).
Рекомбинантный GFAP устойчив к циклам
замораживания-оттаивания
Мы протестировали иммунохимическую стабильность
рекомбинантного GFAP после нескольких циклов
замораживания-оттаивания. В качестве проверки во время
исследований мы восстанавливали лиофилизированный
белок в дистиллированной воде или однопроцентном BSA.
Иммунореактивность прототипа с использованием пары
GFAP83cc-GFAP81cc существенно не изменилась даже после
десяти циклов замораживания-оттаивания белка (см. Рисунок
5).
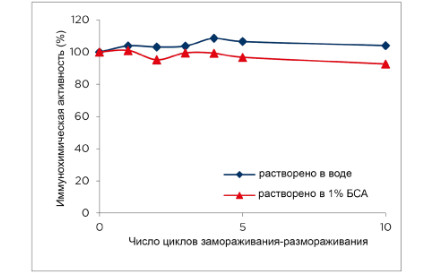
Рисунок 5. Стабильность рекомбинантного GFAP при
замораживании-оттаивании. Лиофилизированный
рекомбинантный GFAP, восстановленный в
дистиллированной воде или 1% BSA, подвергался десяти
циклам замораживания-оттаивания. Иммунореактивность
после каждого цикла измеряли с помощью
сэндвичиммуноанализа (GFAP83cc – GFAP81cc).
Ссылки
- Middeldorp, J. & Hol, E. M. GFAP in health and disease.
Progress in Neurobiology 93, 421–443 (2011).
- Foerch, C. et al. Diagnostic accuracy of plasma glial
fibrillary acidic protein for differentiating intracerebral
hemorrhage and cerebral ischemia in patients with
symptoms of acute stroke. Clinical Chemistry 58, 237–245
(2012).
- Papa, L. et al. Time course and diagnostic accuracy of
glial and neuronal blood biomarkers GFAP and UCH-L1 in
a large cohort of trauma patients with and without mild
traumatic brain injury. JAMA Neurology 73, 551 (2016).
- Vos, P. E. et al. GFAP and S100B are biomarkers of
traumatic brain injury: An observational cohort study.
Neurology 75, 1786–1793 (2010).
- U.S. Food & Drug Administration. FDA authorizes
marketing of first blood test to aid in the evaluation of
concussion in adults. FDA (2018). At www.fda.gov/news-events/press-announcements/fda-authorizesmarketing-first-blood-test-aid-evaluation-...
- Herrmann, M. et al. Release of glial tissue-specific proteins
after acute stroke: A comparative analysis of serum
concentrations of protein S-100B and glial fibrillary acidic
protein. Stroke 31, 2670–2677 (2000).
Информация для заказа
Моноклональные антитела
| Название
продукта |
Кат. No |
Клон |
Подкласс |
Примечания |
| Глиальный
фибриллярный
кислый белок
(GFAP) |
4G25 |
GFAP15cc |
IgG1 |
In vitro, ИФА, ВБ, ИГХ |
| GFAP81cc |
IgG1 |
In vitro, ИФА, ВБ, ИГХ |
|
|
| GFAP83cc |
IgG1 |
In vitro, ИФА, ВБ, ИГХ |
|
|
| GFAP94cc |
IgG1 |
In vitro, ИФА, ВБ |
| GFAP98cc |
IgG1 |
In vitro, ИФА, ВБ |
| GF5 |
IgG2b |
ИФА, ВБ, ИФ, ИГХ |
Антигены
Посмотреть продукцию:






