 С-реактивный белок человека (СРБ) является одним из так называемых белков острой фазы. Его концентрация в крови быстро увеличивается в ответ на воспаление. СРБ представляет собой 224 остатка белка с молекулярной массой мономера приблизительно 25 кДа и pI 6,4 (1-4). Его относят к пентраксинам, эволюционно консервативному семейству белков, характеризующемуся кальций-зависимым связыванием лиганда и радиальной симметрией пяти мономеров, образующих кольцо вокруг центральной поры (5).
С-реактивный белок человека (СРБ) является одним из так называемых белков острой фазы. Его концентрация в крови быстро увеличивается в ответ на воспаление. СРБ представляет собой 224 остатка белка с молекулярной массой мономера приблизительно 25 кДа и pI 6,4 (1-4). Его относят к пентраксинам, эволюционно консервативному семейству белков, характеризующемуся кальций-зависимым связыванием лиганда и радиальной симметрией пяти мономеров, образующих кольцо вокруг центральной поры (5).
Точная функция СРБ в естественных условиях еще не полностью ясна. Было показано, что СРБ участвует в воспалительных процессах, а также в процессах врожденного иммунитета. Важная биологическая активность СРБ определяется его способностью связываться с различными лигандами, такими как: поврежденные клеточные мембраны, апоптозные клетки и фибронектин, с наибольшим сродством к остаткам фосфохолина. Когда СРБ связан с лигандом, это может быть распознано компонентом комплемента C1q, что приводит к активации классического пути комплемента. С другой стороны, посредством взаимодействия с фактором комплемента H, CRP регулирует альтернативный путь комплемента (6).
СРБ в диагностике
В клинической практике С-реактивный белок используют в качестве основного, хотя и довольно неспецифичного, маркера воспаления. Как правило, у здоровых людей уровень СРБ обычно составляет менее 5 мг/л. При патологии концентрация СРБ имеет огромный 10 000-кратный динамический диапазон (приблизительно 0,05–500 мг/л) (7). Самые высокие уровни СРБ (выше 30 мг/л) наблюдаются при бактериальных инфекциях, таких как септический артрит, менингит и пневмония.
В 2003 году Центры по контролю и профилактике заболеваний (CDC) и Американская кардиологическая ассоциация (AHA) опубликовали заявление, в котором CRP был назван маркером воспаления, наиболее подходящим для использования в современной клинической практике для оценки риска сердечно-сосудистых заболеваний (8). Многие эпидемиологические исследования показали, что СРБ является надежным независимым предиктором будущих сердечно-сосудистых событий, включая инфаркт миокарда, ишемический инсульт, заболевание периферических сосудов и внезапную сердечную смерть без каких-либо признаков сердечно-сосудистых заболеваний (согласно обзору Clearfield (9)). Рекомендации CDC/AHA поддерживают использование CRP в первичной профилактике и устанавливают пороговые значения в соответствии с категориями относительного риска: низкий риск (<1,0 мг/л), средний риск (1,0-3,0 мг/л) и высокий риск (> 3,0 мг/л). Именно почему современные высокочувствительные наборы для определения СРБ (hsCRP) направлены на распознавание уровней СРБ в нанограммах на миллилитр (нг/мл).
|
Клиническое использование
- Прогнозирование рисков сердечно-сосудистых заболеваний
- Воспаление
|
Реагенты для разработки hsCRP тестов
Моноклональные антитела Хайтест были использованы в новых иммунометрических аналитических системах, которые достигают превосходной чувствительности с линейным диапазоном обнаружения от 0,025 мг/л до 2,5 мг/л в магнитном биосенсорном анализе (10), и от 0,01 мг/л до 50 мг/л в иммунохемилюминометрическом анализе (11). В обоих случаях предел обнаружения составлял 0,004 мг/л. Предел обнаружения 0,0011 мг/л был достигнут в твердофазном сэндвич-флуоресцентном иммуноанализе с использованием нанокристаллов (12). Наши лучшие пары C2сс–C6сс и C5–СРБ135 и несколько других обеспечивают 10 000-кратную линейность в экспериментальных иммунофлуориметрических анализах. Наши антитела могут быть использованы для разработки высокочувствительных анализов для детекции СРБ для различных диагностических платформ. В дополнение к моноклональным антителам, мы также предоставляем очищенный нативный С-реактивный белок.
Таблица 1. Патологии, приводящие к повышению уровня СРБ
| Инфекции |
Бактериальные
Системные/тяжелые грибковые
|
| Аллергические осложнения после инфекции
|
Ревматическая лихорадка
Узловатая эритема
|
Воспалительные заболевания |
Ревматоидный артрит
Ювенильный идиопатический артрит
Анкилозирующий спондилит
Псориатический артрит
Системный васкулит
Ревматическая полимиалгия
Болезнь Рейтера
Болезнь Крона
Семейная средиземноморская лихорадка
|
Некроз |
Инфаркт миокарда
Эмболизация опухоли
Острый панкреатит
|
Травмы |
Хирургия
Ожоги
Переломы
|
| Злокачественные опухоли |
Лимфома
Карцинома
Саркома
|
Моноклональные антитела, специфичные к СРБ
Приложения
В нативной молекуле СРБ каждый протомер имеет двух-координированные ионы Ca2+ (13). Хайтест предлагает моноклональные антитела к СРБ, которые чувствительны или нечувствительны к присутствию Ca2+ в растворе. Некоторые из наших антител распознают антиген только в присутствии Ca2+ (клоны C3, C4). Большинство моноклонов Хайтест не зависят от присутствия Ca2+ в сэндвич-иммуноанализе и способны эффективно распознавать антиген даже в присутствии EDTA в тестируемом образце (клоны C1, C2, С2сс, C5, C6, С6сс, С7, CRP11, CRP30, CRP30cc, CRP36, CRP103, CRP135, CRP169). Все антитела к СРБ компании Хайтест тестировались в различных иммунологических приложениях.
Прямой ИФА
Все моноклональные антитела к СРБ нашей компании были протестированы в прямом ELISA и выявляли нативный СРБ с высокой чувствительностью. Большинство антител распознают нативный белок как при наличии, так и в отсутствии Ca2+, тогда как клон C3 связывается с СРБ только в присутствии ионов Ca2+ (рис.1 и рис.2).
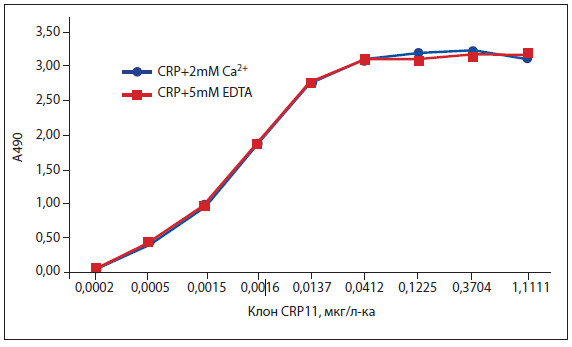
Рисунок 1.Взаимодействие клона CRP11 с нативным СРБ человека в прямой ELISA. 100 нг нативного СРБ (Хайтест) наносили на лунки в трис-буферном солевом растворе, содержащем 2 мМ CaCl2 или 5 мМ ЭДТА.
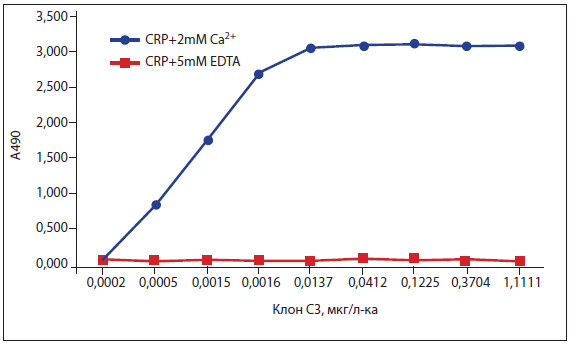
Рисунок 2. Взаимодействие клона C3 с нативным СРБ человека в прямом ИФА. 100 нг/лунку нативного СРБ (Хайтест) наносили на лунки в трис-буферном солевом растворе, содержащем 2 мМ CaCl2 или 5 мМ ЭДТА.
Иммунодетекция СРБ в Вестерн-блоттинге
Клоны C1, CRP11, CRP36 и CRP169 распознают человеческий СРБ в вестерн-блоттинге после переноса антигена на нитроцеллюлозную мембрану. Результаты экспериментов, иллюстрирующих иммунодетекцию СРБ в вестерн-блоттинге с помощью антител CRP36 и CRP169, представлены на рис. 3.
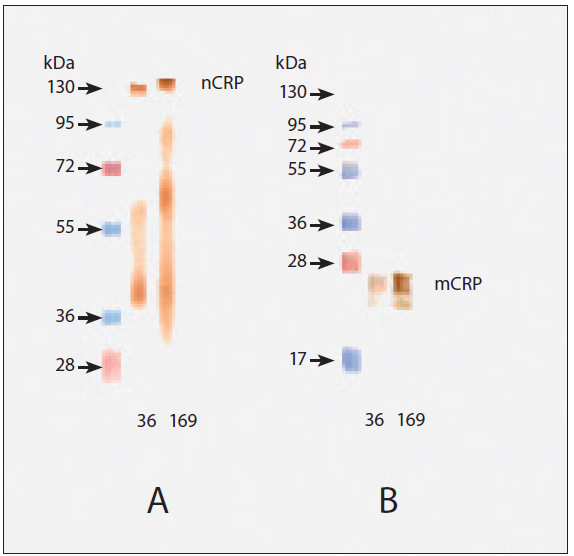
Рисунок 3. Иммунодетекция С-реактивного белка с использованием моноклональных антител к СРБ в Вестерн-блоттинге после гель-электрофореза в SDS. Нативный СРБ наносили на гель в невосстанавливающих (А) или восстанавливающих (В) условиях. После электрофореза белок переносили из геля на нитроцеллюлозную мембрану и зондировали с помощью моноклонов CRP36 и CRP169. A: СРБ в невосстанавливающих условиях после гель-электрофореза SDS по Тейлору и Ван дер Бергу (14). B: СРБ в восстанавливающих условиях после гель-электрофореза SDS. Для визуализации МоАт были конъюгированы с HRP (стрептавидин-конъюгат пероксидазы хрена) и 3,3-диаминобензидинтетраги дрохлоридом (DAB) в качестве субстрата HRP.
Высокочувствительные иммуноаналитические анализы к СРБ
Все клоны были протестированы в сэндвич-флюороиммунологическом анализе в качестве антител для захвата и обнаружения с сывороткой человеческой крови при наличии или отсутствии ионов Ca2+. Лучшие пары, рекомендуемые для использования (захват - обнаружение):
- С2сс - С6сс
- С5 - С6сс
- С7 - С6сс
- C5 - CRP135сс
- CRP30cc - CRP135сс
- C3 - C6cc (чувствителен к Ca2+)
- C2cc - C4сс (чувствителен к Ca2+)
Калибровочные кривые для пар C2сс-С6сс и C5-CRP135сс показаны на рис. 4 и рис. 5 соответственно.
Моноклональные антитела производства ХайТест распознают антиген СРБ с отличной чувствительностью и хорошей кинетикой, в диапазоне линейности, превышающем четыре порядка.
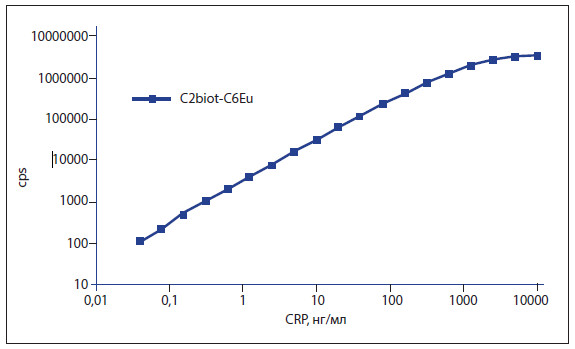
Рисунок 4. Иммунодетекция СРБ (стандарта) в сэндвич-иммуноанализе
по паре C2-C6.
Клон C2 – биотинилированный.
Клон C6 помечен стабильным хелатом Eu3+.
Смесь антител и образцы антигенов (100 мкл) инкубировали в течение 10 мин при комнатной температуре с нанесённым на планшеты стрептавидином
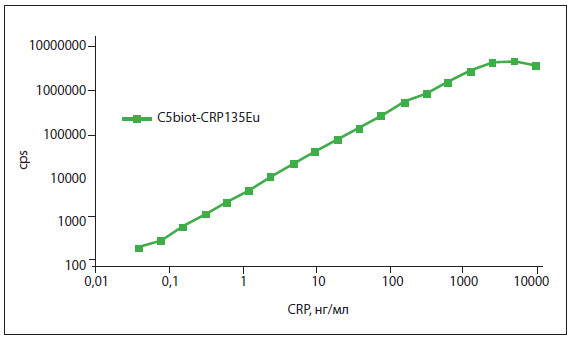
Рисунок 5. Иммунодетекция СРБ в сэндвич-иммуноанализе парой антител C5- СРБ135.
Клон C5 – биотинилированный.
Клон СРБ135 помечен стабильным хелатом Eu3+.
Смесь антител и образцы антигенов (100 мкл) инкубировали в течение 30 мин при комнатной температуре в планшетах, покрытых стрептавидином.
Некоторые рекомендованные пары моноклональных антител нашей компании чувствительны к наличию этилендиаминтетрауксусной кислоты (ЭДТА) в растворе, остальные нечувствительны к ней (рис. 6). Пара C5 - CRP135сс и некоторые другие могут применяться вместе с ионами Ca2+, так и без них. Пара моноклонов C3-C6сс сильно подвержена влиянию кальция.
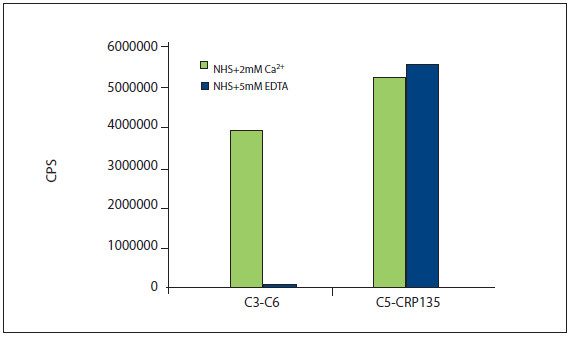
Рисунок 6. Влияние ЭДТА на измерения СРБ. Две разные пары антител были использованы в сэндвич-иммуноанализе. Пара C3-C6 (слева) показывает зависимость от ионов Ca2+, так как данная пара не распознает СРБ в присутствии EDTA. Пара C5-СРБ135 (справа), напротив, не зависит от EDTA в растворе. В качестве источника СРБ использовали нормальную человеческую сыворотку с добавлением 2 мМ CaCl2 или 5 мМ ЭДТА.
Информация об аффинности антител
Для некоторых приложений - турбидиметрии, нефелометрии или конкурентного иммуноанализа,-необходимо оценивать константы аффинности используемых антител. ХайТест предлагает ряд МоАт с различной аффинностью к СРБ (таблица 2). Мы оценили константы аффинности для некоторых из них с использованием технологии Biacore®. Она основана на эффекте поверхностного плазмонного резонанса, который позволяет оценить взаимодействие между двумя белками в режиме реального времени. Константа аффинности получается путём визуализации констант скорости ассоциации и диссоциации. Кинетика выбранных нами моноклональных антител различается, что делает их подходящими для разработки иммуноанализа на СРБ с широким динамическим диапазоном. Выбранные кинетические значения наших антител к СРБ представлены на рисунке 7.
Таблица 2. Константы аффинности некоторых моноклональных антител к СРБ.
|
Клон |
Kon (1/Ms) |
Koff (1/s) |
Kd (M) |
| C2cc |
2.3 x 105 |
4.4 x 10-4 |
1.93×10-9 |
| C5 |
1.3 x 105 |
2.2 x 10-3 |
1.7×10-8 |
| CRP30cc |
9.3 x 103 |
4.0 x 10-3 |
4.3×10-7 |
| CRP135cc |
1.5 x 105 |
6.6 x 10-4 |
4.4×10-9 |
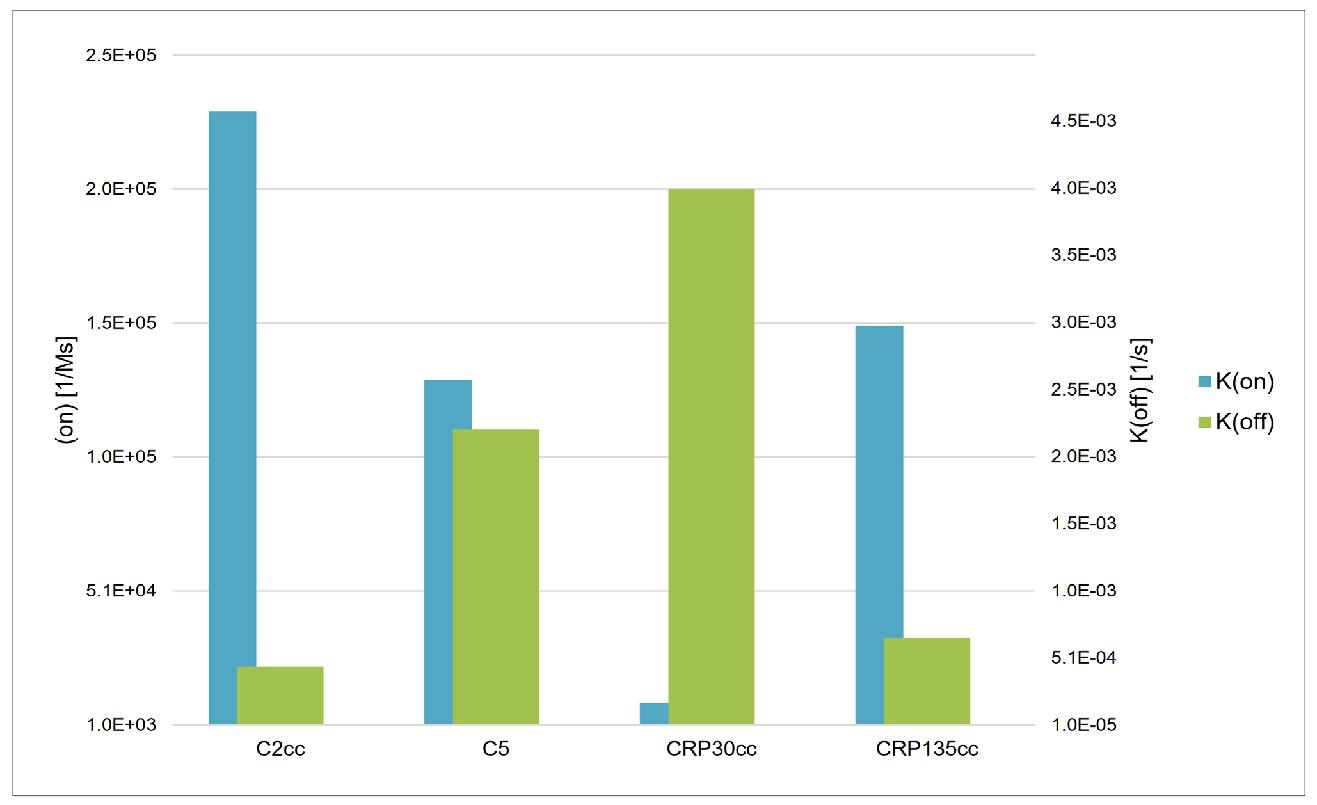
Рисунок 7. Кинетические значения МоАт нашей компании к СРБ. В левой колонке указано значение Kon, в правой – Koff.
Рекомбинантный СРБ человека
Выработка СРБ в печени начинается мгновенно
после единичного стимулирования, а концентрация
в сыворотке поднимается выше 5 мг/мл примерно
через 6 часов, достигая пиковых значений примерно
через 48 часов. Период полураспада СРБ в плазме
составляет около 19 часов, вне зависимости от
состояния здоровья и наличия каких-либо болезней
(12).
Таким образом, концентрация циркулирующего СРБ
зависит исключительно от скорости выработки/синтеза
СРБ, по которой можно судить об интенсивности
патологических процессов, инициировавших эту
выработку СРБ (17).
Рекомбинантный СРБ человека нашей компании
экспрессируется в клетках млекопитающих и
очищается в нативных условиях, исключающих
этапы ренатурации. Рекомбинантный СРБ человека
очищают с помощью аффинной хроматографии с
фосфатидилхолиновой матрицей, что свидетельствует
о функциональной активности рекомбинантного
белка.
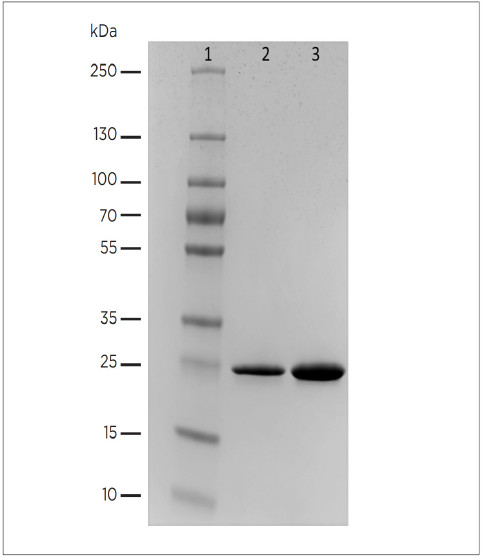
Рисунок 8. SDS-PAGE рекомбинантного СРБ человека в восстанавливающих условиях.
-
маркеры молекулярной массы
-
рекомбинантный СРБ человека, 2 мкг
-
рекомбинантный СРБ человека, 5 мкг
Наш рекомбинантный CRP человека (кат. No 8CR8) не
содержит меток. Он находится в форме, оптимальной
для хранения в жидком состоянии. Чистота белка
составляет более 95% (см. рис. 8). Результаты
применения рекомбинантного СРБ человека в
анализах с различными парами МоАт нашей компании
представлены на рисунке 9.
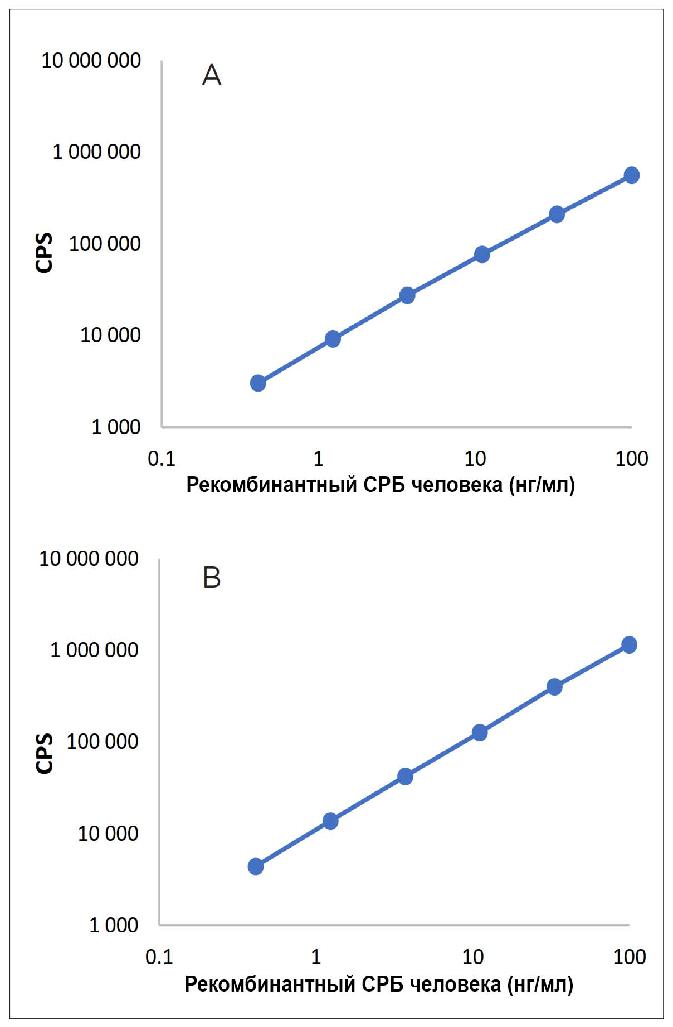
Рисунок 9. Калибровочная кривая для рекомбинантного СРБ человека.
A) Калибровочная кривая пары CRP30cc-CRP135cc и B) C2cc-C4cc (захват-обнаружение). Антитела подложки адсорбировали на микропланшетах для иммунологического анализа. Смесь антигенов и детектирующих антител, помеченных стабильным хелатом Eu3+, инкубировали в течение 30 минут при комнатной температуре.
Ссылки на литературу
- Yasojima Koji et al. ” Generation of C-Reactive Protein
and Complement Components in Atherosclerotic
Plaques.” Am J Pathol. 2001 March; 158(3): 1039–1051.
- Kobayashi S, Inoue N, et al. “Interaction of oxidative
stress and inflammatory response in coronary plaque
instability: important role of C-reactive protein.”
Arterioscler Thromb Vasc Biol 2003, 23:1398–1404.
- Ciubotaru I., Potempa L.A., Wander R.C. “Production
of Modified C-Reactive Proteinin U937-Derived
Macrophages”. Exp Biol Med (Maywood) 2005,
230(10):762-70.
- Diehl E. E. et al. ”Immunohistochemical Localization of
modified C-reactive protein antigen in normal vascular
tissue.” American Journal of the Medical Sciences 2000;
319(2):79.
- Hirschfield G.M., Pepys M.B. “C-reactive protein and
cardiovascular disease: new insights from an old
molecule.” Q J Med 2003; 96:793-807.
- Thompson D., Pepys M.B., Wood S.P. “The physiological
structure of human Creactive protein and its complex
with phosphocholine.” Structure 1999; 7:169-177.
- Bıro A. et al. ”Studies on the interactions between
C-reactive protein and complement proteins”
Immunology 2007 May;121(1):40-50.
- Lowe G.D.O., Pepys M.B. ”C-Reactive Protein and
Cardiovascular Disease: Weighing the Evidence”
Current Atherosclerosis Reports 2006, 8:421–428.
- Ridker P.M. “C-reactive protein: a simple test to help
predict risk of heart attack and stroke” Circulation.
2003; 108:e81-e85.
- Clearfield M.B. “C-reactive protein: a new risk
assessment tool for cardiovascular disease” JAOA
2005; 105(9):409-416.
- Pearson T.A et al. “Markers of inflammation and
cardiovascular disease: application and public health
practice: A statement for healthcare professionals from
the Centers for Disease Control and Prevention and
the American Heart Association”. Circulation 2003 Jan
28;107(3):499-511.
- Pepys M.B & Hirschfield G.M. “C-reactive protein: a
critical update.” J Clin Invest Jun 2003;111(12):1805-1812.
- Meyer M.H. et al. “CRP determination based on a novel
magnetic biosensor.”Biosens Bioelectron 2007 Jan 15;
22(6):973-9.
- Shiesh S.C. et al. “Determination of C-reactive protein
with an ultra-sensitivity immunochemiluminometric
assay”. J Immunol Methods 2006 Apr 20;311(1-2):87-95.
- Sin K.K. et al. “Fluorogenic nanocrystals for highly
sensitive detection of C-reactive protein.” IEE Proc
Nanobiotechnol 2006 Jun;153(3):54-8.
- Karolina E. Taylor and Carmen W. van den Berg
“Structural and functional comparison of native
pentameric, denatured monomeric and biotinylated
C-reactive protein.” Immunology 2006; 120, 404–411.
- Gershov D. et al. “C-reactive protein binds to
apoptic cells, protects the cells from assembly of the
terminal complement components, and sustains an
antiinflammatory innate immune response: implications
for systemic autoimmunity.” J Exp Med 2000;192:1353-
1363.
Поиск ссылок о С-реактивном белке в PubMed.
Посмотреть все ссылки о CRP.
Информация для заказа.
Моноклональные антитела
| Название продукта |
Кат. № |
Клон |
Изотип |
Примечания |
|
C-реактивный белок |
4C28 |
C1 |
IgG2b |
ИФА, ВБ , высокочувствительные |
|
|
|
C3 |
IgG1 |
ИФА, ИГХ, Ca2+ зависимые,
высокочувствительные
|
|
|
|
C5 |
IgG1 |
ИФА, высокочувствительные |
|
|
|
C7 |
IgG1 |
ИФА, ИГХ, высокочувствительные |
|
|
|
CRP11 |
IgG1 |
ИФА, ВБ |
|
|
|
CRP36 |
IgG2a |
ИФА, ВБ, ИГХ |
|
|
|
CRP169 |
IgG2a |
ИФА, ВБ |
|
|
4C28cc |
C2cc |
IgG1 |
In vitro, ИФА, высокочувствительные |
|
|
|
C4cc |
IgG1 |
In vitro, ИФА, Ca2+ зависимые,
высокочувствительные
|
|
|
|
|
|
|
|
|
|
C6cc |
IgG2a |
In vitro, ИФА, высокочувствительные |
|
|
|
CRP30cc |
IgG1 |
In vitro, ИФА, низкая аффинность |
|
|
|
CRP135сс |
IgG2b |
In vitro, ИФА, высокочувствительные |
Антиген
Новинка!
| Название продукта |
Кат. № |
Чистота |
Источник |
|
С-реактивный белок (СРБ) человека, рекомбинантный
|
8CR8
|
>95% |
Рекомбинантный |
Узнать подробнее:

 С-реактивный белок человека (СРБ) является одним из так называемых белков острой фазы. Его концентрация в крови быстро увеличивается в ответ на воспаление. СРБ представляет собой 224 остатка белка с молекулярной массой мономера приблизительно 25 кДа и pI 6,4 (1-4). Его относят к пентраксинам, эволюционно консервативному семейству белков, характеризующемуся кальций-зависимым связыванием лиганда и радиальной симметрией пяти мономеров, образующих кольцо вокруг центральной поры (5).
С-реактивный белок человека (СРБ) является одним из так называемых белков острой фазы. Его концентрация в крови быстро увеличивается в ответ на воспаление. СРБ представляет собой 224 остатка белка с молекулярной массой мономера приблизительно 25 кДа и pI 6,4 (1-4). Его относят к пентраксинам, эволюционно консервативному семейству белков, характеризующемуся кальций-зависимым связыванием лиганда и радиальной симметрией пяти мономеров, образующих кольцо вокруг центральной поры (5).








