Фибриноген – это белок крови, из которого
образуются сгустки фибрина при свертывании крови или тромботическом
процессе. Фибриноген состоит из двух одинаковых субъединиц, которые
содержат три полипептидные цепи: α, β и γ. Во время свертывания крови
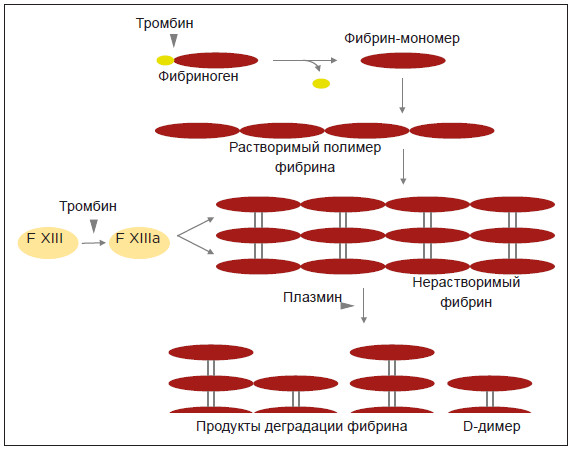
фибриноген сначала превращается в фибрин под действием тромбина, затем эти
мономеры фибрина полимеризуются с образованием сгустков фибрина. При фибринолизе
сгустки фибрина расщепляются плазмином, и в кровоток высвобождаются продукты
разложения фибрина (FDP) с разной молекулярной массой.
D-димер (молекулярный вес 180 кДа)
является конечным продуктом разложения фибрина. Он состоит из остатков
всех трех цепей (α, β и γ цепей) фибриногена, сшитых дисульфидными
связями. Димерная структура D-димера поддерживается двумя ковалентными
межмолекулярными изопептидными связями между γ-цепями.
Д-димер в диагностике
Уровни D-димера у здоровых людей
составляют менее 0,5 мкг/мл. Повышенные уровни D-димера были обнаружены в крови
пациентов с тромбозом легких (или тромбоэмболией легочной артерии – ТЭЛА),
тромбозом глубоких вен (ТГВ) и атеросклерозом. Считается, что повышенный
уровень D-димера в крови является надежным маркером патологической коагуляции,
которая лежит в основе патогенеза большинства сердечно-сосудистых заболеваний
(1, 2). Он широко используется для исключения диагноза тромбоза глубоких вен
(3).
Несмотря на долгую историю
использования теста на D-димер в клинической практике, существует много
проблем, касающихся количественного определения D-димера в образцах плазмы. Плазма
пациента содержит широкий спектр FDP разных размеров наряду с самим D-димером. Все
эти продукты обладают эпитопом D-димерного антигена. Следовательно, антитела,
специфичные к D-димеру, также распознают FDP. Тем не менее, существует большая
разница между результатами, полученными различными иммунодиагностическими
тестами. Это можно объяснить различиями в специфичности антител; некоторые
антитела и пары антител распознают D-димер лучше, чем FDP и наоборот. До сих
пор все попытки стандартизации и гармонизации не привели к удовлетворительным
результатам, и это является распространённой причиной проблем в повседневной
практике (4).
Для точного определения всех FDP и D-димера, и
для использования D-димера в качестве стандарта
моноклональные антитела должны обнаруживать
FDP и D-димер с одинаковой специфичностью. Кроме
того, наборы на D-димер не должны обнаруживать
фибриноген, концентрация которого в плазме в 1000
раз выше, чем концентрация D-димера.
|
Клиническое использование
- Маркер патологического свертывания крови
- Исключение тромбоза любой этиологии, в т.ч. вызывающего ТГВ или ТЭЛА
|
Разработка иммунометрических систем и
рекомендованные пары антител
Для разработки иммунометрических аналитических
систем для определения D-димера мы предлагаем ряд
моноклональных антител, специфичных к D-димеру
и FDP. В дополнение к антителам мы предлагаем
D-димер, который производится из свернувшегося
фибриногена путем расщепления плазмином.
Моноклональные антитела, специфичные к
D-димеру и FDP
FDP и D-димер, наиболее деградированная форма
FDP, появляются в крови человека в результате
протеолитического расщепления сгустков фибрина.
Соотношение продуктов деградации фибрина
не является постоянным и может отличаться от
пациента к пациенту (см. Рис. 3). Мы разработали
иммунометрическую систему, которая распознает
FDP и D-димер с одинаковой специфичностью,
что позволяет снизить погрешность в измерении
FDP в крови. Такой подход может в перспективе
стать первым серьезным шагом к созданию единой
универсальной методики анализа D-димера.
Количественный сэндвич-иммуноанализ,
одинаково специфично определяет D-димер и
FDP
Хайтест предлагает моноклональные антитела
DD189сс и DD255сс, которые распознают D-димер
и высокомолекулярные продукты разложения
фибрина с одинаковой специфичностью в сэндвич-
флюороиммуноанализе при концентрации антигена
до 1 мкг/мл (рис. 2).
Для «сэндвич»-ИФА плазму можно развести
в 10-кратном 20 мМ трис-HCl-буфере, рН 7,5,
содержащем 0,15 М NaCl. Оба клона окрашивали
D-димер в вестерн-блоттинге в восстанавливающих
и невосстанавливающих условиях (рис. 5 A и B).
Характеристика моноклонов DD189сс и DD255сс
представлена в статье Kogan et al. (5)
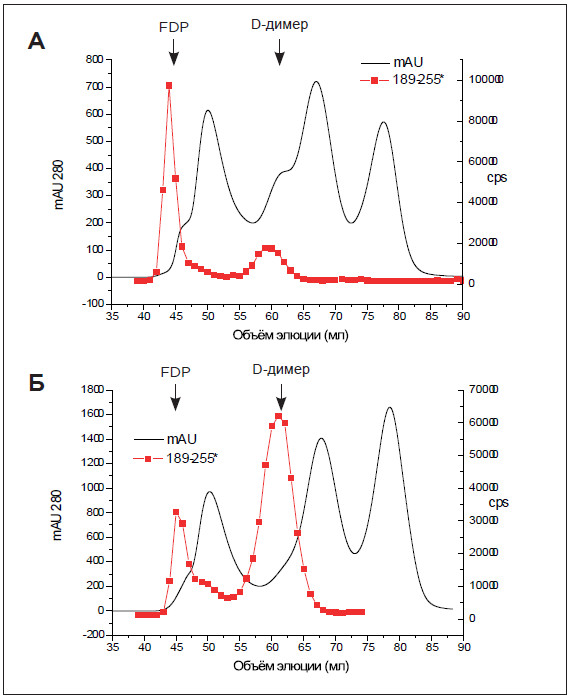
РИСУНОК 2. Пара антител DD189сс-DD255сс определяет D-димер
и FDP с одинаковой специфичностью. В лунки планшета нанесли
100 мкл клона DD189сс (10 мкг/мл в PBS) и инкубировали в течение 1
часа при комнатной температуре. После трех промывок трис-буферным
солевым раствором (TBS), содержащим 0,05% Tween 20, добавили 50
мкл меченного Eu3 + клона DD255сс (4 мкг/мл в буфере для анализа
Delfia) и 25 мкл D-димера или FDP. Инкубировали, перемешивая, в
течение 1 часа при комнатной температуре. После промывки в каждую
лунку добавили 300 мкл раствора Lanfia, и после 3 минут интенсивного
перемешивания измерили флуоресцентные сигналы на 1420 Victor ™
Multilabel Counter (Wallac, Финляндия).
Соотношение D-димера и FDP отличается у
разных пациентов
Мы провели анализ плазмы от пациентов с
двумя различными расстройствами с помощью
гель-фильтрации, в результате которого было
установлено, что соотношение D-димера и FDP
не является постоянным (рис. 3). Следовательно,
иммуноаналитические системы должны в равной
степени распознавать D-димер и FDP, чтобы
обеспечить более точное определение всех
продуктов распада, возникающих в результате
разложения фибрина.
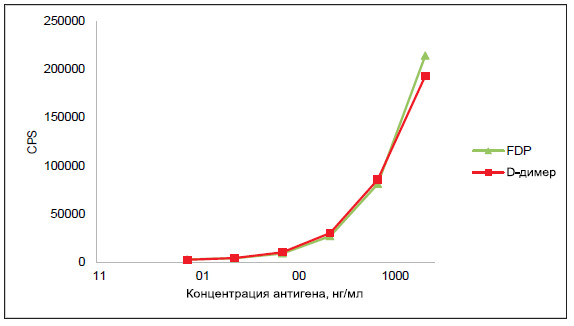
РИСУНОК 3. ВЭЖХ гель-фильтрация образцов плазмы от пациентов
с тромбозом (А) и после хирургической операции (Б). 200-500 мкл
плазмы наносили на колонку Superdex 200 16/60 со скоростью потока 1
мл/мин. Фракции объемом 1 мл анализировали парой DD189-DD255 в
сэндвич-ИФА, как описано на рис.2.
Рекомендации по парам антител для
количественного сэндвич-иммуноанализа
Рекомендованные пары представлены в
таблице 1. Они успешно распознают D-димер и
высокомолекулярные продукты разложения фибрина
и не обнаруживают фибриноген (рис. 4).
ТАБЛИЦА 1. Рекомендуемые пары для сэндвич-ИФА для
обнаружения D-димера в плазме человека. Обратите внимание, эти
рекомендации и наблюдения основаны на полученных результатах с
использованием нашей собственной иммунометрической платформы
DELFIA®.
| Пара (подложка-
конъюгат) |
Примечания |
| DD189cc – DD255cc |
Одинаковая специфичность к D-димеру и
высокомолекулярным продуктам деградации
фибрина |
| DD2 – DD41cc |
Более специфичная пара к
высокомолекулярным продуктам деградации
фибрина при высоких концентрациях |
| DD2 – DD4* |
Приблизительно одинаковая специфичность
к д-димеру и высокомолекулярным
продуктам деградации фибрина |
* Ввиду кросс-реактивности DD4 с фибриногеном, мы настоятельно
рекомендуем использовать его в качестве детектирующего антитела.
В сэндвич-иммуноанализе плазма должна быть разведена, по крайней
мере, в 2-кратном растворе 10 мМ Трис-HCl, рН 7,5, 1 М NaCl, 0,1%
Твин 20, чтобы избежать неспецифического связывания. Каждый из
следующих этапов иммуноанализа должен сопровождаться инкубацией
и промывкой: нанесение моноклонального антитела на подложку,
добавление образца, а позже – конъюгированного моноклонального
антитела.
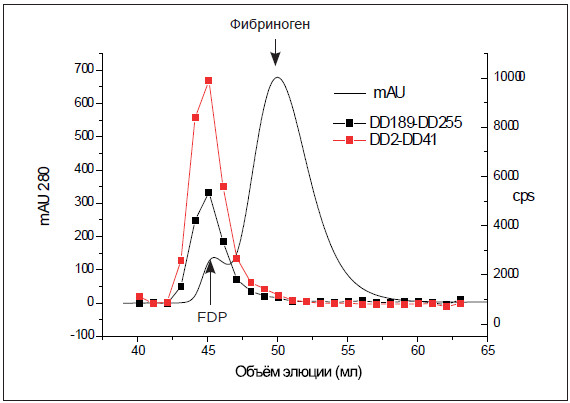
РИСУНОК 4. Кросс-реактивность с фибриногеном при
использовании в иммунометрических системах пар антител DD2-
DD41 и DD189-DD255 отсутствует. 5 мг фибриногена (Calbiochem)
наносили на колонку Superdex 200 16/60 с использованием TBS, pH 7,5
при скорости потока 1 мл/мин. Фракции объемом 1 мл анализировали в
сэндвич-анализе с помощью пар DD2-DD41 и DD189-DD255, как описано
на рисунке 3(у финов рис.3, в русской – 2). Результаты показывают, что
иммунометрические системы на D-димер не обнаруживают фибриноген,
несмотря на присутствие некоторых высокомолекулярных продуктов
деградации фибрина в препарате.
Моноклональные антитела к D-димеру могут
быть использованы в вестерн-блоттинге
Наши антитела к D-димеру также могут применяться
при методе вестерн-блоттинга. В проведенных
тестах все моноклональные антитела окрашивали
невосстановленный D-димер, а некоторые из них
окрашивали и восстановленный D-димер (рис. 5 A и
B соответственно).
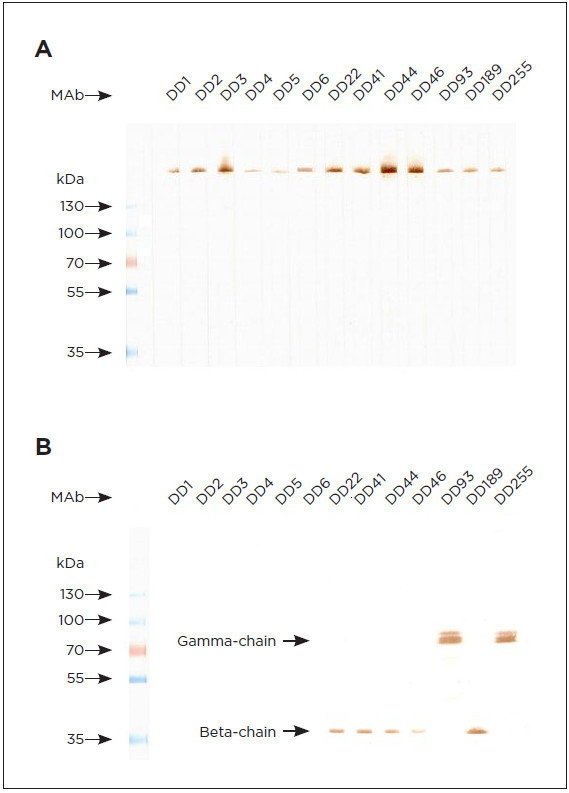
РИСУНОК 5. Вестерн-блот D-димера. D-димер (кат. № 8D70)
анализировали в ДСН-ПААГ в невосстанавливающих (A) или
восстанавливающих (B) условиях с использованием разделяющего геля
7,5–12,5% и переносили на нитроцеллюлозную мембрану. Мембрану
блокировали 7% молоком в PBST в течение 30 минут, полосы белка
окрашивали различными моноклональными антителами к D-димеру (10
мкг/мл) в течение 1 часа, используя Mini-Protean® II MultiScreen (Био-
Рад). После промывания с помощью PBST, добавляли пероксидазный
конъюгат козьих анти-мышиных антител специфичных к Fc-фрагменту
IgG (разведённый в соответствии с рекомендациями производителя)
и инкубировали в течение часа. После промывания PBST иммунные
комплексы визуализировали с помощью DAB/перекиси водорода в 50
мМ трис-HCl буфере, pH 7,5.
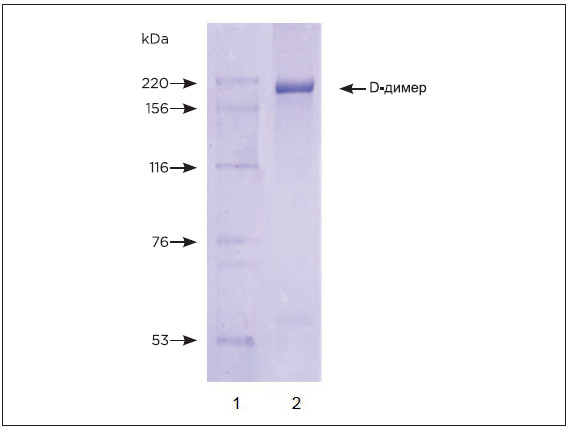
D-димер человека
Уже более 10 лет Хайтест является одним из
ведущих мировых поставщиков нативного D-димера.
Мы предлагаем D-димер высокой степени очистки,
полученный из человеческой плазмы.
РИСУНОК 6. SDS-PAGE очищенного D-димера в
невосстанавливающих условиях. Гель окрашивали с использованием
кумасси бриллиантового голубого R-250.
Полоса 1: Весовой стандарт
Полоса 2: D-димер (3 мкг)
Информация для заказа.
Моноклональные антитела
| Название продукта |
Кат. № |
Клон |
Подкласс |
Примечания |
| D-димер |
4D30 |
DD1 |
IgG2a |
ИФА, ВБ, Нет к/р с фибриногеном |
| DD2 |
IgG2b |
ИФА, ВБ, Нет к/р с фибриногеном |
| DD3cc |
IgG2b |
In vitro, ИФА, ВБ, Нет к/р с фибриногеном |
| DD4 * |
IgG2b |
ИФА, ВБ, К/р с фибриногеном (для обнаружения MAb) |
| DD5 * |
IgG2b |
ИФА, ВБ, К/р с фибриногеном (для обнаружения MAb) |
| DD6cc * |
IgG2a |
In vitro, ИФА, ВБ, К/р с фибриногеном (для обнаружения MAb) |
| DD22 |
IgG2a |
ИФА, ВБ, Нет к/р с фибриногеном |
| DD41cc |
IgG2a |
In vitro, ИФА, ВБ, Нет к/р с фибриногеном |
| DD44cc |
IgG2b |
In vitro, ИФА, ВБ, Нет к/р с фибриногеном |
| DD46 |
IgG2a |
ИФА, ВБ, Нет к/р с фибриногеном |
| DD93 |
IgG1 |
ИФА, ВБ, Нет к/р с фибриногеном |
| DD189cc * |
IgG1 |
ИФА, ВБ, Нет к/р с фибриногеном |
| DD255cc * |
IgG1 |
ИФА, ВБ, Нет к/р с фибриногеном |
* Примечание. При использовании данных антител в качестве детекторных, иммуноаналитический набор может давать ложноположительные
результаты у пациентов, получавших стрептокиназу.
Антиген
| Название продукта |
Кат. № |
Чистота |
Источник |
| D-димер |
8D70 |
>90% |
Плазма человека |
Обратите внимание, что некоторые или все данные, представленные в настоящем техническом описании, были подготовлены с использованием моноклональных антител, произведенных in vivo. Ожидается, что моноклональные антитела, полученные in vitro, будут иметь аналогичные характеристики.
Ссылки на литературу
- Bounameaux H, et al. (1994) Plasma measurement of D-dimer as diagnostic aid in suspected venous thrombo-embolism: an overview. Thromb Haemost. 71, 1-6.
- Rowbotham BJ, et al. (1987) Measurement of crosslinked fibrin derivatives – use in the diagnosis of venous thrombosis. Thromb Haemost. 57, 59-61.
- Righini M, et al. (2008) D-Dimer for venous thrombo-embolism diagnosis: 20 years later. J Thromb Haemost. 6, 1059-71.
- Reber G. and de Moerloose P. (2009) Standardization of D-dimer testing. Quality in Laboratory and Thrombosis 99-109.
- Kogan, AE et al. (2016) Monoclonal antibodies with equal specificity to D-dimer and high-molecular-weight fibrin degradation products. Blood Coagul. Fibrinolysis. 27: 542–550.
Посмотреть продукцию:








